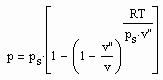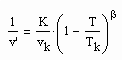Archive for the ‘nahkritische Stoffdaten von Flüssigkeiten und Gasen’ Category
Die nun einfache Möglichkeit der Berechnung von pvT-Daten in der kritischen Region eines Stoffes
Freitag, März 28th, 2014


Zur Berechnung von Stoffwerten für Flüssigkeiten und Gase in der kritischen Region von Stoffen
Donnerstag, Januar 23rd, 2014Ganz allgemein ist ja leider festzustellen, daß alle bisherigen in der chemischen Technik und Verfahrenstechnik angewendeten Zustandsgleichungen, selbst die modernsten, nicht in der Lage sind, die realen pvT- Verhältnisse eines Stoffes mit ausreichender Genauigkeit in der kritischen Region darzustellen. Das bestätigen Aussagen zur Genauigkeit in der kritischen Region z. B. auch in der wichtigen und modernen web- site „nist webbook“, die pvT- Werte oft angewendeter Stoffe der chemischen Industrie mit den aktuell besten empirischen Zustandsgleichungen nach Anpassung an Meßwerte angibt (s. auch den Artikel „Zur Genauigkeit der Berechnung von pvT- Daten in der kritischen Region“ vom 15.4.2013). Auch die Erwartung, daß sich mit den von der Theoretischen Physik festgestellten Gesetzmäßigkeiten kritischer Phänomene akzeptable Berechnungsgleichungen ohne oder geringe empirische Anteile ergeben könnten, die zwar nicht der klassischen van der Waals- Thermodynamik und den daraus resultierenden Gleichungen bis hin zur sogen. molekularen Thermodynamik entsprechen, aber doch ausreichenden Genauigkeitsansprüchen genügen, hat sich seit Jahren nicht erfüllt.
Mit nun vorliegenden Untersuchungsergebnissen zum pvT- Verhalten reiner Stoffe in der kritischen Region ist versuchsweise ein Theorie- Ansatz abgeleitet worden, der zu einer Erweiterung von Gesetzmäßigkeiten kritischer Phänomene weit über ihre bisherige Anwendbarkeit begrenzt auf die nahe Umgebung des kritischen Punktes führt. So ergeben sich z. B. Berechnungsgleichungen für die kritische Isotherme und benachbarte Isothermen, die die pvT- Verhältnisse in der Nähe des kritischen Punktes eines Stoffes allein nur bei Kenntnis der kritischen Daten pk, vk, Tk bei guter Annäherung an die Realität wiedergeben. Allerdings ist dieser Ansatz außerhalb des bisherigen Main- Streams. Die von manchen theoretischen Physikern vertretene Ansicht, kritische Exponenten seien analog einer Naturkonstanten unabhängig vom Stoff und etwa konstant, bestätigt sich mit diesem Theorie- Ansatz nur teilweise. Der kritische Exponent β bestätigt sich stoffunabhängig mit ca. 1/3, der Exponent δ allerdings erweist sich als stoffabhängig berechenbar mit den kritischen Daten.
Die van der Waals- Thermodynamik und die vielen auf dieser Grundlage abgeleiteten Zustandsgleichungen gelten ja nicht in der kritischen Region. Hier gelten die Gesetzmäßigkeiten kritischer Phänomene, deren Wirksamkeit nachgewiesen und von der Theorie her erklärt ist- aber doch noch nicht soweit entwickelt ist, dass man für technische Zwecke verlässlich damit rechnen könnte. Veröffentlichte Stoffwerte für Zustände in der kritischen Region können deshalb mit erheblichen Fehlern behaftet sein, wie die Autoren von Stoffwertdaten selbst einschätzen. Die Situation der Bestimmung von Zustandsdaten in der Umgebung des kritischen Punktes eines Stoffes ist bereits in verschiedenen Artikeln dieses Blogs näher dargestellt: „Die Anwendbarkeit kritischer Phänomene zur Berechnung von pvT- Daten“ vom 23.2.2013; „Zur Genauigkeit der Berechnung von pvT-Daten in der kritischen Region“ vom 15.4.2013. Die in Datensammlungen und in der Literatur beschriebenen Berechnungsgrundlagen beziehen sich auf supergenaue Messungen in der kritischen Region und auf jeweils weitgehende empirische Zustandsgleichungen für technisch wichtige Stoffe. Allgemeingültige Lösungen ausreichender Genauigkeit können nicht genannt werden.
Nun ergab es sich nach den o. gen. speziellen Untersuchungen des Verhaltens von Stoffen in der kritischen Region, dass eine Hypothese zur näherungsweisen Erweiterung des Gültigkeitsbereichs kritischer Phänomene sowohl für Zustände um den kritischen Punkt als auch für Zustände weiter entfernt vom kritischen Punkt zu der Realität weitgehend nahekommenden Ergebnissen führt (Angaben zur Theorie und ihre Anwendungen s. z. B. den Artikel „Eine Zustandsgleichung für reale Gase- abgeleitet aus der Theorie kritischer Phänomene“ vom 1.5. 2009). Nachrechnungen der pv- Daten kritischer Isothermen gut vermessener Stoffe zeigen das, indem die Berechnungsergebnisse entsprechend der neuen zur Theorie kritischer Phänomene abgeleiteten Möglichkeiten mit Ergebnissen von bisher angewendeten Zustandsgleichungen- dokumentiert in „nist webbook“- verglichen werden. Zu betonen ist, dass zur Bestimmung der pv-Werte auf der kritischen Isotherme entsprechend der neuen Berechnungsmöglichkeiten nur die Kenntnis der kritischen Daten pk, vk, Tk notwendig ist, während die von renommierten Autoren angewendeten weitgehend empirischen Zustandsgleichungen umfangreiche Messungen und Anpassungen erfordert haben. Beispiele zum Vergleich der Ergebnisse des neuen Theorie- Ansatzes mit denen nach herkömmlichen weitgehend empirischen Zustandsgleichungen renommierter Autoren auf der Grundlage sehr genauer Messungen und Anpassungen können nach Anforderung (dr.f.tampe@t-online.de) zur Verfügung gestellt werden (für Benzol, Toluol, Ethylen, Kohlenstoffdioxid, Propylen, Helium, Wasserstoff, Methanol…usw.). Auch verwendbare Nachrechnungen für pvT- Daten von Stoffen, zu denen keine Meßwerte außer denen der kritischen Daten in der kritischen Region existieren, sind nun vorstellbar! Das ist durchaus für bisher nicht weiter vermessene Stoffe bei nur der Kenntnis der kritischen Daten zu erwarten (entsprechende Anfragen ebenfalls an die o.gen. Mail- Adresse bei kostenloser Bearbeitung, falls die Ergebnisse nach Absprache zur Auswertung benutzt werden dürfen).
Sehr interessant ist es auch, dass es mit den neuen Möglichkeiten zur Berechnung von pv- Daten auf Isothermen möglich ist, die Sättigungsdaten v‘, v“ von Flüssigkeiten und Dämpfen entsprechend der Temperatur als Näherungen zu bestimmen. Für die v‘-, v“-Volumina von Stoffen kurz unter der kritischen Temperatur eines Stoffes und weiter entfernt von der kritischen Temperatur können so Berechnungsgleichungen abgeleitet werden. Diese Gleichungen geben die Sättigungsvolumina von Flüssigkeiten und Dämpfen als Temperaturfunktion und als Näherung an. Die Genauigkeit der Flüssigkeitsdaten ist dabei oft recht hoch und entsprechend von Meßwerten erheblich besser als die der Dampfdaten. Anfragen zu solchen Nachrechnungen o. gen. Art sind möglich. Es ist darauf hinzuweisen, daß es bisher keine allgemein gültige Möglichkeit gibt, die Sättigungsvolumina von Stoffen als Näherung zu berechnen.
Einige interessante Beispiele zur Stoffwertberechnung auf der Grundlage kritischer Phänomene
Dienstag, Mai 7th, 2013Die Auswertung von Gesetzmäßigkeiten kritischer Phänomene, die von der Theoretischen Physik abweichend von der sonst üblichen van der Waals- Thermodynamik festgestellt sind, ergab eine Zustandsfunktion als Zusammenhang zwischen Druck p, Volumen v und Temperatur T der Form
Dabei ist ps der Dampfdruck und v“ das Sättigungsdampfvolumen.
Im Ergebnis der Untersuchungen zu Siededaten von Stoffen, die aus Gesetzmäßigkeiten kritischer Phänomene ableitbar sind, ergab sich für weitab von der kritischen Temperatur befindliche Temperaturen die grob näherungsweise bestehende Beziehung
Dabei ist β der kritische Exponent mit dem Betrag 1/3 , Tk ist die kritische Temperatur , vk das kritische Volumen und v‘ das Siedevolumen bei einer weit von der kritischen Temperatur entferntenTemperatur. Die Größe K erweist sich dabei als eine dimensionslose allgemeine Konstante der Größenordnung grob allgemein von 3.7 (in einem Variationsbereich von 3 bis 4- oft also bei 3.7) (s. Tampe. F. : „Stoffwerte von Flüssigkeiten und realen Gasen- berechnet mit Gesetzmäßigkeiten kritischer Phänomene“- ISBN 978-3-00-027253-0). Es ist also immer möglich, das Flüssigkeitsvolumen v‘ eines Stoffes für weitab von der kritischen Temperatur entfernte Temperaturen einzuschätzen- selbst wenn nichts weiter außer den Daten des kritischen Punktes bekannt ist. Damit erweist es sich dann letztlich als möglich, nahkritische pvT- Stoffdaten als Näherung zu berechnen (s. die Artikel „Die Anwendbarkeit krit. Phänomene zur Berechnung von pvT- Daten“ vom 23.2.2013, „Mitteilung zu Zustandsgleichungen für reale Gase und Flüssigkeiten- abgeleitet aus der Theorie kritischer Phänomene“ vom 16.11.2012, „Zur Berechnung nahkritischer Stoffdaten von Flüssigkeiten und Gasen“ vom 1.7.2012).
In sehr vielen Fällen sind pvT- Daten von Stoffen in der Umgebung des jeweiligen normalen Siedepunkts vom Tripelpunkt bis zu höheren Temperaturen bekannt. Es kann aber auch sein, daß nur die kritischen Daten bekannt sind und sonst fast keine Angaben zu wichtigen Stoffwerten (außer denen z. B. zu Feststoffdaten) vorliegen. Leider ist das oft so- wie Beispiele aus Stoffdatenbanken bzw. web- Informationen zeigen.
Es kann also sehr schwierig oder sogar unmöglich werden, Stoffdaten allein durch Rechnung bestimmen oder einschätzen zu wollen, wenn nur wenige Meßwerte bekannt sind- z. B. in all den Fällen bei allein nur bekannten kritischen Daten. Die Situation ist allerdings verbessert, wenn die nun bekannten Veränderungen durch die festgestellte Erweiterbarkeit von Gesetzmäßigkeiten kritischer Phänomene auch auf Temperaturen weit ab von der kritischen Temperatur beachtet werden.
Für all diese Fälle, deren Stoffdaten bei allein nur bekannten kritischen Daten zumindest als grobe Näherung mit Gesetzen kritischer Phänomene bestimmt werden können, sollen nachfolgend einige interessante Beispiele dargelegt werden.
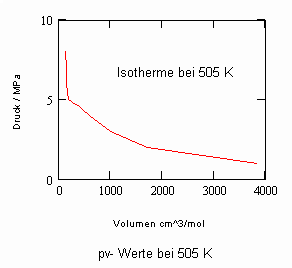
Ein seit vielen Jahren wichtiger Stoff bei der Isotopentrennung von Uran 235 und Uran 238 ist Uranhexafluorid UF6, wobei die Trennung in Gaszentrifugen geschieht. Das technische know how dieses Prozesses ist aus verständlichen Gründen keineswegs völlig offen. Auch die Stoffdaten sind in allgemein zugänglichen Datensammlungen der Literatur und Datenbanken des web nur teilweise zugänglich.
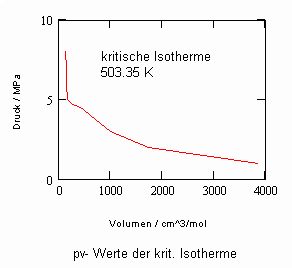
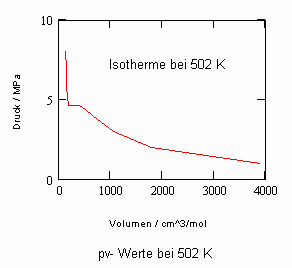
Verfügbar sind z. B. die Daten des kritischen Punktes: Tk = 503.35 K (230.2 °C), pk = 4.66 MPa, vk = 256 cm³/mol. Allein mit diesen Angaben (und sonst keinen weiteren) ist es nun möglich, mit den sich aus kritischen Phänomenen ergebenden neuen Berechnungsgleichungen die pvT- Daten der kritischen Region rechnerisch einzuschätzen. Auch die pv-Werte auf Isothermen überkritischer Temperaturen, die sich weiter entfernt von der kritischen Temperatur befinden, können nun so als Näherungen ermittelt werden. Die nachfolgenden Diagramme, die pv- Daten für nahkritische Temperaturen angeben, sind das Ergebnis solcher nun möglicher Rechnungen für Uranhexafluorid.
Rechnungen für technisch relevante pvT- Daten von UF6 erweisen sich nun als durchaus möglich!
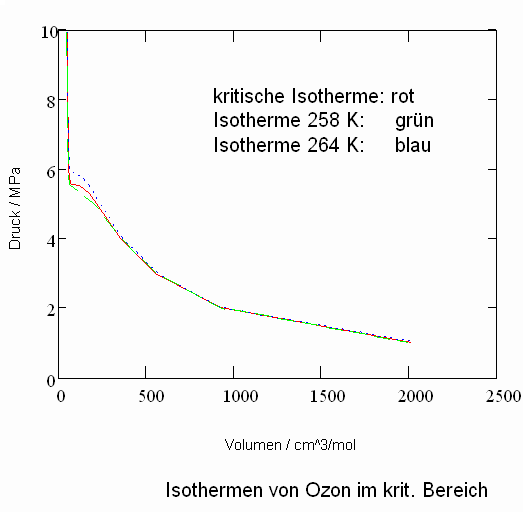
Ein weiteres Beispiel eines wichtigen Stoffes mit nur unvollständigen Angaben in frei verfügbaren Datenbanken ist Ozon O3. Angegeben werden i.a. die kritischen Daten für Temperatur, Druck und Volumen Tk = 261.05 K, pk = 5.46 MPa, vk = 89.38 cm^3/mol. Auch der normale Siedepunkt bei 161.25 K und der Tripelpunkt bei 80.45 K wird genannt.
Allein mit solchen Angaben ist es nun auf der Grundlage der gen. Gesetzmäßigkeiten kritischer Phänomene möglich, pvT- Daten in der kritischen Region und darüber hinaus zu berechnen. Für Ozon z. B. ergeben sich so die folgenden Diagramme für Isothermen in der kritischen Region.
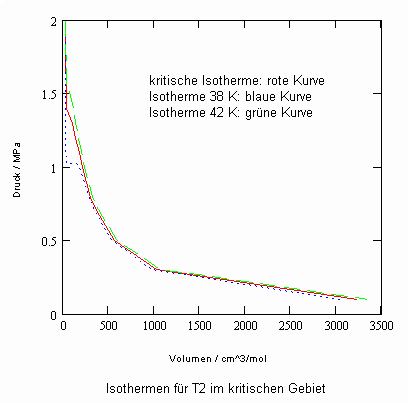
Ein anderes interessantes Beispiel zur Erfassung von pvT-Daten in der kritischen Region ist Tritium T2. Das Molekül besteht aus zwei Tritium- Atomen, wobei der Tritiumkern selbst aus zwei Protonen und einem Neutron besteht. Die folgenden Daten werden in internationalen Datenbanken genannt: Tk = 40.55 K, vk = 57.0576. Der normale Siedepunkt wird mit 25.03 K angegeben.
Für Tritium T2 können als Näherung die folgenden pvT- Daten in der kritischen Region entsprechend folgenden Diagramms berechnet werden:
Für viele weitere Stoffe können nun was hier gezeigt werden sollte- bei bekannten kritischen Daten näherungsweise pvT- Angaben für das kritische Gebiet und auch weit darunter bzw. darüber berechnet werden!
Zur Genauigkeit der Berechnung von pvT- Daten in der kritischen Region
Montag, April 15th, 2013Für technisch wichtige Stoffe existieren heute recht genaue Zustandsgleichungen, die die Variablen Druck p, Temperatur T und Volumen v bzw. die Dichte ρ sowohl im Flüssigkeits- als auch im Gaszustand miteinander verbinden. Da es für die in der verfahrenstechnisch – großtechnischen Praxis bestehenden Anforderungen auf eine hohe Genauigkeit ankommt, reichen Berechnungsgleichungen auf Modellvorstellungen der Theoretischen Physik (auf der Basis der van der Waals- Gleichung und ihren vielen sogen. halbempirischen Weiterentwicklungen, der Virialgleichung usw. bis hin zur sogen. molekularen Thermodynamik) nicht aus. Deshalb müssen immer noch Zustandsgleichungen mit ausgeprägt empirischen und stoffspezifischen Anteilen verwendet werden, um die erforderliche Genauigkeit zu ermöglichen. Der Aufwand ist hoch. Er setzt sehr genaue und umfangreiche pvT- Messungen des jeweiligen Stoffes voraus, um die erforderlichen Anpassungen der experimentell ermittelten Zustandsdaten an Parameter vorausgesetzter Zustandsgleichungen zu ermöglichen. Die Erfolge dieser Vorgehensweise mit weitgehend empirischen und „halbempirischen“ Zustandsgleichungen sind offensichtlich.
Selbst für den die menschliche Existenz begründenden Stoff „Wasser“ sind solch weitgehend empirische Zusammenhänge auf der Grundlage sehr genauer pvT- Messungen entwickelt worden (entsprechend der sogen. IAPWS formulation- „International Association for the Properties of Water and Steam“), keineswegs aber auf der alleinigen Grundlage eines nur physikalisch begründeten Modells. Auch für die wichtigen Stoffe der Erdöl- und Erdgasgewinnung und Verarbeitung- wie z.B. Methan, Ethan……bis Benzol, Toluol usw.- existieren Zustandsgleichungen dieser Art.
Meßwerte vieler Substanzen sind heute in Datenbanken dokumentiert, die einen schnellen Zugriff (allerdings oft gebührenpflichtig) über das Internet gestatten (s. z.B. die umfangreiche Stoffdatensammlung „dechema.de/detherm“). Die Bereitstellung von Stoffdaten geht unterdessen so weit, für eine Vielzahl technisch wichtiger Stoffe komplette pvT-Datensätze und auch kalorische Daten anzugeben (s. „nist webbook“), die nach Vorgabe von Druck und Temperatur entsprechend der jeweiligen Dichte bzw. des Volumens mit einer weitgehend an Meßwerte angepaßten Zustandsgleichung ermittelt wurden- und das sowohl für die flüssige Phase und auch für die Gasphase und überkritische Zustände. Die Fehler dabei sind durchaus gering und liegen oft nur im Prozentbereich oder sogar darunter. Sie sind so geeignet für verfahrenstechnische Auslegungen großtechnischer Prozesse mit solchen Stoffen.
Dies alles trifft zu nur für pvT- Zustände weiter entfernt von den kritischen Daten. Soll bei Vorgabe von Druck und Temperatur in einem nahkritischen Bereich die Dichte bzw. das Volumen eines Stoffes mit einer solchen Zustandsgleichung bestimmt werden (dokumentiert z.B. in „nist webbook“) ist das zwar möglich- die Fehler aber werden dann oft als „höher“ im Vergleich zu den Fehlern angegeben, die in Zuständen weiter entfernt von den kritischen Daten festgestellt sind. So heißt es dann z.B. bei nist webbook für Ammoniak: „The uncertainties of the equation of state are o.2% in density….., except in the critical region“.
Und so etwa lauten ähnliche Feststellungen für auch ander Stoffe:
– „Uncertainties will be higher near the critical point“- nist webbook für H2S
– „In the critical region the uncertainties are higher for all properties, except vapor pressure“- nist webbook für SO2.
Die Liste von Stoffen mit der Aussage „except in the critical region“ zu den in der Literatur angegebenen Zustandsgleichungen kann fortgesetzt werden, z. B. mit solchen grundlegenden und strukturell einfachen Stoffen wie Pentan, Propylen, Methan u.a. So ist also die Feststellung gerechtfertigt, dass die Ungenauigkeiten bisheriger veröffentlichter Zustandsgleichungen speziell in der kritischen Region selbst nach den durchgeführten sehr genauen pvT-Messungen und Anpassungen immer noch recht hoch sind. Der Aufwand ist hoch in Relation zum Ergebnis.
Die Hoffnung, dass sich mit den von der Theoretischen Physik festgestellten Gesetzmäßigkeiten kritischer Phänomene akzeptable Berechnungsgleichungen ohne empirische Anteile ergeben könnten, die zwar nicht der klassischen van der Waals- Thermodynamik und den daraus resultierenden Gleichungen bis hin zur sogen. molekularen Thermodynamik entsprechen, aber doch ausreichenden Genauigkeitsansprüchen genügen, hat sich seit Jahren nicht erfüllt.
Nun hat es sich aus theoretischen Erwägungen zur Physik kritischer Phänomene ergeben, einen anderen als bisherige Ansätze zur Auswertung dieser Phänomene zu verfolgen.
Das bisherige Theorie- Ergebnis ist, dass man bei Kenntnis nur der kritischen Daten eines Stoffes weitgehend zutreffende Näherungsaussagen zum pvT- Verlauf der kritischen Isotherme bzw. von nahkritischen Isothermen erhalten kann- ohne zusätzliche Meßwerte. Für Stoffe also, zu denen keine weiteren Messungen außer denen der kritischen Daten vorliegen, können dann zumindest Näherungen des Isothermen -Verlaufs in der kritischen Region abgeleitet werden. Da das für sehr, sehr viele Stoffe zutrifft, ist es also durchaus möglich, die Daten der kritischen Isotherme und auch pv-Daten etwas unterhalb und oberhalb der kritischen Temperatur als Näherung zu berechnen. Nähere Ausführungen zur Theorie und zu Beispielrechnungen sind im Artikel vom 1.7.12 in www.dr-tampe.de u.a. enthalten.
Bisher war es nicht möglich, die Sättigungsvolumina der siedenden Flüssigkeit und des Sattdampfes für Temperaturen kurz unter der kritischen Temperatur vorauszuberechnen. Mit den neuen Theorie- Ergebnissen zu kritischen Phänomenen erweist sich das unterdessen als möglich. Die berechneten Volumina sind Näherungen, die durchaus weitgehend mit Meßwerten übereinstimmen (s. Artikel“ Die Berechnung von Daten für Zustände kurz unter der kritischen Temperatur“ in www.dr-tampe.de .)
Zur Berechnung nahkritischer Stoffdaten von Flüssigkeiten und Gasen
Sonntag, Juli 1st, 2012Aus der physikalischen Theorie kritischer Phänomene kann für reale Gase die Zustandsfunktion
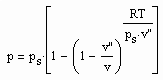 (1)
(1)
für Zustände entfernt vom kritischen Punkt bzw. für kleine bis mäßige Drücke abgeleitet werden (p- Druck/ MPa, ps- Dampfdruck/ MPa, T- Temperatur / K, v- molares Volumen / cm³/mol, v“- molares Sattdampfvolumen / cm³/mol ). Die Funktion (1) ist als grobe Näherung anwendbar. Sie ist anwendbar auch für hohe Temperaturen, sogar bis über die kritische Temperatur hinaus. Ihre Anwendbarkeit für Zustände nahe des kritischen Punktes ( einige Kelvin unterhalb und oberhalb der kritischen Temperatur Tk und für Drücke in der Nähe des kritischen Druckes pk ) ist nicht zu erwarten, da hier besondere und andere Bedingungen gelten, die sich aus Gesetzmäßigkeiten kritischer Phänomene im Unterschied zur bisherigen van der Waals- Thermodynamik ergeben.
Auf der kritischen Isotherme können entsprechend der Gesetzmäßigkeiten kritischer Phänomene nahe des kritischen Druckes die Relationen
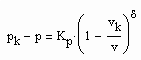 (2)
(2)
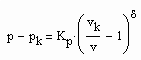 (3)
(3)
vorausgesetzt werden. Dabei ist Kp ein Proportionalitätsfaktor und δ der entsprechende kritische Exponent. (2) gilt für p ‹ pk , (3) gilt für p › pk.
Für p,v – Zustände nahe pk, vk ist (2), (3) zwingend mit einem in der Theorie kritischer Phänomene erklärten kritischen Exponenten zu rechnen. Der kritische Exponent δ ist resultierend aus Messungen in der Größenordnung von 4.0 bis 4.8 festgestellt worden (s. z. B. Nolting, W.: Statistische Physik, Springer Verlag 2004). Es gibt Physiker, die kritische Exponenten im Sinne absoluter Naturkonstanten unabhängig vom Stoff interpretieren und andere, die eine Stoffabhängigkeit in Grenzen zugestehen. Setzt man die weitgehende Stoffunabhängigkeit voraus, verbleibt der Proportionalitätsfaktor Kp als Unbekannte. Es besteht die Frage, wie ist der Proportionalitätsfaktor Kp zu bestimmen, um Zustände auf der kritischen Isotherme berechnen zu können?
Sinnvoll ist es, die Frage allgemeiner zu stellen. Nämlich: Wie können nahkritische Zustandsdaten mit ausreichender Genauigkeit nicht nur für Zustände auf der kritischen Isotherme, sondern auch für Temperaturen kurz unter- und oberhalb der kritischen Temperatur bestimmt werden? Bisherige physikalisch begründete als auch die sogen. halbempirischen Zustandsgleichungen u.a. reichen nicht aus. Auch die von der bisherigen Theoretischen Physik erklärten Ansätze, die die rechnerische Bestimmung des Proportionalitätsfaktors Kp ohne Meßwerte kaum erlauben, reichen nicht aus. Für technisch wichtige Stoffe ist deshalb die Physikalische Chemie und Verfahrenstechnik auf empirische stoffspezifische Lösungen bei einem hohen meßtechnischen Aufwand angewiesen (vielparametrige empirische Zustandsgleichungen pro Stoff bei Voraussetzung hochgenauer Stoffwerte) ( s. z. B. die Stoffdaten für Erdgaskomponenten, für Kohlenstoffdioxid CO2, für Wasser usw. mit weitgehend empirischen Zustandsgleichungen von Wagner und Span, Universität Bochum, s. E.W. Lemmon u. R. Span: Multiparameter Equations of State for Pur Fluids and Mixtures. Chapter 12, in A.R.H. Goodwin, J.V. Sengers und C.Peters(Ed.): Applied Thermodynamics of Fluids. International Union of Pure and Applied Chemistry, Royal Society of Chemistry, Thomas Graham House,Cambridge, UK 2010)).
Bisherige Feststellungen und Schätzungen kritischer Exponenten für dreidimensionale physikalische Systeme mit einem Ordnungsparameter in der entsprechenden Universalitätsklasse wurden z. B. in Auswerung des Issing – Modells mit dem kritischen Exponenten β = 0.326 + – 0.002 und δ = 4.80+- 0.02 vorausgesetzt (s. z. B. J.V. Senger: Thermodynic Behavior of Fluids near the critical Points, Ann. Rev. Phys.Chem. 1986,37).
Vorliegende Ergebnisse zu Gesetzmäßigkeiten kritischer Phänomene bestätigen zwar die Existenz des kritischen Exponenten β in der Größenordnung von 1/3, nicht aber die Gültigkeit eines allgemeinen Exponenten δ etwa bei 4.8. Das in der Theoretischen Physik gen. Werteintervall δ = 4.0 bis 4.8 trifft zu und ist nach den vorliegenden Untersuchungen durchaus noch zu klein.
Die nachfolgenden Feststellungen weisen darauf hin, daß es möglich ist, einen physikalisch begründeten und empiriefreien Ansatz zur Nachrechnung nahkritischer Daten ohne zusätzlichen Meßaufwand zu finden.
Bestimmt man für die kritische Isotherme vergleichsweise für verschiedene Stoffe den Exponenten RTk/pk vk in (1), ist festzustellen: Es gibt Stoffe, deren Exponent RTk/pk vk in (1) in dem für den kritischen Exponenten δ erklärten Bereich zwischen 4.0 bis 4.8 liegt. Für Wasser z. B. ergibt sich 4.36, für Ammoniak NH3 4.12. Für solche Stoffe ist die weitgehende Gültigkeit der Funktion (1) auch im nahkritischen Bereich zu erwarten. Die kritische Isotherme sollte in diesen Fällen entsprechend (1) mit
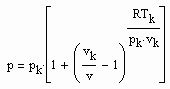 v‹ vk (4)
v‹ vk (4)
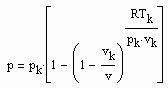 v›vk (5)
v›vk (5)
erfaßt werden können.
Ob das tatsächlich so ist, zeigt die Nachrechnung mit Daten gut vermessener Stoffe wie z. B. für Wasser.
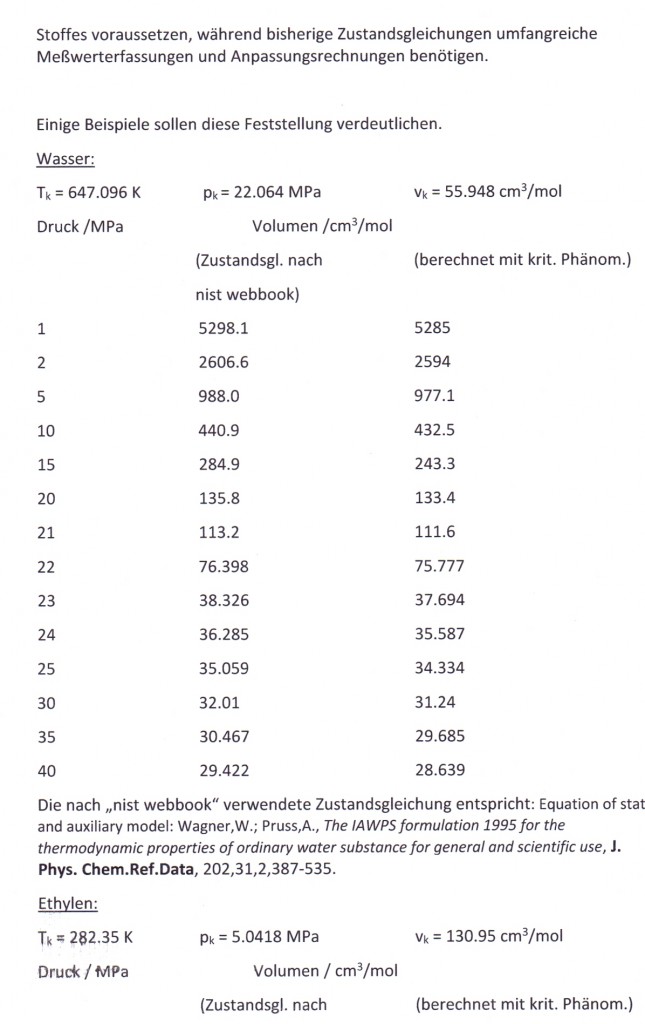
Wasser: (Tk= 647.15 K, pk= 22.055 MPa, vk= 55.9503 cm³/mol)
Bei einer Temperatur 648.15 K (375 °C, also 1°C über der kritischen Temperatur) und einem hypothetischen Dampfdruck von 22.286 MPa ergeben sich mit den o. gen. Funktionen (4), (5) im Vergleich mit aus Meßwerten berechneten Realgasfaktoren die folgenden Werte (außerdem sind die Werte angegeben, die sich mit einer der oft angewendeten Ingenieurgleichungen, der Soave- Redlich- Kwong- Gleichung berechnen lassen).
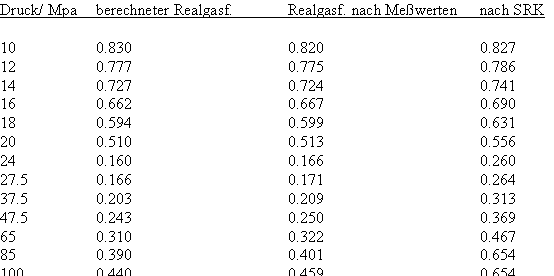
(Meßwerte L. Haar, J.S. Gallagher, G.S. Kell: NBS/NRC Wasserdampftafeln, Springer 1988)
Ein weiteres für die kritische Isotherme vermessenes und veröffentlichtes Beispiel ist
Schwefelhexafluorid SF6: (Tk= 318.7232 K, pk= 3.755 MPa, vk= 196.576 cm³/mol)
Bei einer Temperatur genau auf der kritischen Isotherme ergeben sich mit den o.gen. Funktionen (4), (5) im Vergleich mit aus Meßwerten berechneten Realgasfaktoren die folgenden Werte:

Die gen. Beispiele u.a. zeigen die Anwendbarkeit der Funktionen (4), (5) für kritische Verhältnisse.
Für Stoffe allerdings, deren Exponent RTk/ pk vk nicht in das von der physikalischen Theorie erklärte Wertebereich von ca. 4.0 bis 4.8 für kritische Exponenten fällt, bestehen andere Bedingungen. Allerdings ergibt sich auch für solche Stoffe die Möglichkeit, nahkritische Stoffdaten rechnerisch zu bestimmen. Es ist dazu nur die Kenntnis der kritischen Daten und die vorausgesetzte Temperatur ohne weitere Meßwerte erforderlich.
Die so feststellbare Zustandsfunktion p = p(T,v) gestattet dann auch die Berechnung kalorischer Größen- wie auch der wichtigen Freien Enthalpie für nahkritische Zustände.
Die vorliegenden Theorie – Ergebnisse sollen veröffentlicht werden.
Die sich aus der Theorie kritischer Phänomene ergebenden Weiterentwicklungen ermöglichen es, allgemeine Aussagen zum pvT- Verhalten von Flüssigkeiten abzuleiten. Es ergibt sich eine Zustandsfunktion speziell für Flüssigkeitenvon niedrigen Temperaturen bis hin zu Temperaturen nahe der kritischen Temperatur. Damit kann bei vorgegebener Temperatur und vorgegebenem Druck das molare Volumen einer Flüssigkeit als Näherung selbst bis zu hohen Drücken von einigen 10 MPa und höher berechnet werden, wenn nur die kritischen und die Sättigungsdaten des jeweiligen Stoffes bekannt sind. Die Berechnung der Realgasfaktoren von Flüssigkeiten bis zu hohen Drücken ist somit bei guter Übereinstimmung mit Meßwerten möglich.
Für Flüssigkeitszustände bei Temperaturen niedriger bis mäßiger Dampfdrücke, d.h. weiter entfernt vom kritischen Punkt des jeweiligen Stoffes, ist mit den Mitteln der van der Waals- Thermodynamik die Zustandsfunktion
![]() (6)
(6)
ableitbar (b- Eigenvolumen der Moleküle des Stoffes/ cm³/mol, K-stoffspezifische Konstante mit der Dimension eines Druckes, die sich aus dem Dampfdruck ergibt) (s. Tampe,F.: Stoffwerte von Flüssigkeiten und Gasen- berechnet mit Gesetzmäßigkeiten kritischer Phänomene, 2009, ISBN 978-3-00-027253-0).Auch diese Funktion ermöglicht die Berechnung der Flüssigkeitsvolumina als Näherung für Drücke vom Dampfdruck bis weit darüber hinaus- z.B. für Wasser sogar bis 100 MPa. Mit dieser Funktion (6) und der aus der physikalischen Theorie kritischer Phänomene ableitbaren Zustandsfunktion für Flüssigkeiten nahe kritischer Werte ist die Berechnung von Flüssigkeitsdaten als Näherung in ihrem gesamten Existenzbereich von niedrigen bis zu hohen Temperaturen, vom Dampfdruck bis zu hohen Drücken möglich.
Die in der Technischen Thermodynamik , Physikalischen Chemie und Verfahrenstechnik bestehenden Ansätze, Stoffeigenschaften mit den Mitteln der bisherigen van der Waals- Thermodynamik, der Statistischen Thermodynamik mit Mitteln von Potential- Ansätzen der Quantenmechanik bzw. der sogen. molekularen Modellierung zu bestimmen, erweisen sich oft als kompliziert und empiriebelastet. Als viel einfacher gestalten sich die aus Gesetzmäßigkeiten kritischer Phänomene ableitbaren Berechnungsgleichungen, die nicht einmal Anpassungsrechnungen an vorausgesetzte empirische Parameter verlangen.
Weitere Beispiele zu Rechenergebnissen im Vergleich zu Meßwerten können die Anwendbarkeit der gewonnenen Theorie – Ergebnisse, die Näherungen der entsprechenden Stoffwerte erlauben, verdeutlichen: s. Anlage.
Oftmals sind Meßwerte des nahkritischen Sättigungszustandes von Stoffen unbekannt. Die Berechnung solcher Daten für Flüssigkeits- und Dampfvolumina bzw. für Dampfdrücke in der Nähe der kritischen Temperatur ist mit den gegenwärtig verfügbaren Berechnungsgleichungen (van der Waals- Gleichung, sogen. halbempirische Gleichungen nach Soave, Redlich, Kwong und Peng, Robinson u. a., Gleichungen der Statistischen Thermodynamik usw.) in vielen Fällen nicht möglich bzw. zu ungenau.
In Auswertung von Gesetzmäßigkeiten kritischer Phänomene ergibt sich nun die Möglichkeit, nahkritische Sättigungsvolumina bzw. die nahkritischen Dichten von Stoffen für Flüssigkeit und Dampf im Sättigungszustand in Abhängigkeit von der Temperatur zu berechnen. Die Berechnungsgleichungen dafür liegen vor. Die Ergebnisse sind Näherungen, die für den Flüssigkeitszustand sogar besser sind als für den Sattdampf (s. auch Artikel „Die Berechnung von Daten für Zustände kurz unter der kritischen Temperatur“ vom 22.2.2011 in www.dr-tampe.de )
Auf Folgendes ist hinzuweisen: Wenn die Zustandsfunktion p= p(v,T) eines Stoffes sowohl sowohl für den Flüssigkeits- als auch für den Gaszustand bekannt ist, muß es möglich sein, kalorische Daten dieses Stoffes zu berechnen. Zur Berechnung z.B. der für technische Belange wichtigen Enthalpie gilt
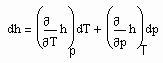 . (7)
. (7)
Da
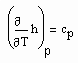 (8)
(8)
die spezifische Wärmekapazität ist, die gemessen werden kann, und für
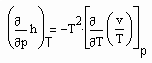 (9)
(9)
gilt, ist damit die Enthalpie eines Stoffes sowohl für den Flüssigkeitszustand als auch den Gaszustand berechenbar. Dies bedeutet weiter, daß so die Enthalpie eines Stoffes entlang der Dampfdruckkurve sowohl für die Flüssigkeit als auch für den Sattdampf als Näherung berechnet werden kann.
Anlage: Berechnungsbeispiele