Eine wichtige Grundlage zur Beschreibung des Verhaltens realer Gase ist bekanntlich die van der Waals- Gleichung. Sie ist auch der Ausgangspunkt für viele Weiterentwicklungen dieser Gleichung- aber dann immer auf weitgehend empirischer Basis.
Die klassische van der Waals- Gleichung beschreibt die Zustände realer Gase und sogar auch von Flüssigkeiten qualitativ richtig, quantitativ aber zur Auslegung technischer Abläufe keineswegs ausreichend. Die Ungenauigkeiten im Zweiphasengebiet und für Daten in der Nähe des kritischen Punktes können groß sein. Vor allem Flüssigkeitszustände werden sehr ungenau oder gar nicht erfaßt. Diese Feststellungen betreffen keineswegs nur die van der Waals-Gleichung, sondern auch die in der Technischen Thermodynamik entstandenen sogenannten “halbempirischen Zustandsgleichungen”von Soave, Redlich, Kwong und Peng, Robinson u.a., die heute weltweit zur Berechnung von Zustandsdaten angewendet werden.
So ist es ja bis heute nicht gelungen, die physikalische Theorie so zu entwickeln, dass die Volumina bzw. Dichten von Stoffen temperaturabhängig entlang der Dampfdruckkurve mit genügender Genauigkeit von der Schmelztemperatur bis zur kritischen Temperatur berechnet werden können. Oftmals besteht auch die Situation, dass mit den gegebenen Gleichungen zwar das Dampf- und Gasverhalten gut erfasst werden kann, nicht aber die Flüssigkeitswerte.
Der Übergang eines Stoffes von seiner flüssigen Form in den Dampfzustand bzw. vom Dampf in die Flüssigkeit- also der Verdampfungsvorgang bzw. die Kondensation – wird im allgemeinen von der physikalischen Theorie her und in der technischen Thermodynamik als beherrschbar und als relativ abgeschlossen angesehen. Das ist so in den meisten Anwendungsfällen. In der Nähe des kritischen Punktes eines Stoffes allerdings treten mit herkömmlichen theoretischen Ansätzen Schwierigkeiten bei der theoretischen Durchdringung des Verhaltens von Stoffen im Phasenübergang auf. Es ergaben sich neue und unerwartete Erkenntnisse, die mit dem Begriff der sogen. “kritischen Phänomene “ zusammengefasst werden.
Phasenübergänge waren ganz allgemein in den letzten Jahrzehnten ein interessanter Gegenstand intensiver physikalischer Forschung. Das Verhalten von Zustandsvariablen beim Phasenübergang nahe am kritischen Punkt eines Stoffes wurde speziell untersucht. Dabei wurden allgemeingültige Ergebnisse über den Verlauf von Zustandsgrößen in Abhängigkeit von der Temperatur erhalten. Die weitgehende Allgemeingültigkeit bestimmter Stoffeigenschaften in der Nähe der kritischen Temperatur wird physikalisch mit den Gesetzmäßigkeiten kritischer Phänomene beschrieben.
Die für Stoffeigenschaften maßgeblichen Wechselwirkungen zwischen den Molekülen und Atomen eines Stoffes haben normalerweise eine Reichweite von nur einigen Molekül- bzw. Atomdurchmessern. Im kritischen Zustand allerdings entsteht ein verblüffend universelles Verhalten physikalischer Größen wegen des Eintretens sogenannter “kritischer Fluktuationen”, die sich wie eine beträchtliche Vergrößerung der Reichweite von Teilchenwechselwirkungen auswirken. Dies hat zur Folge, dass Eigenschaften völlig unterschiedlicher Stoffe in der Umgebung der jeweiligen kritischen Temperatur sich nach analogen Gesetzmäßigkeiten verhalten.
Kritische Phänomene sind erklärt für
– den Dichtesprung zwischen flüssiger und dampfförmiger Phase
– die Differenzen vom Druck zum kritischen Druck bzw. von der Dichte zur kritischen Dichte auf der kritischen Isotherme
– Kompressibilitäten
– Wärmekapazitäten
– magnetische Zustände (Suszeptilitäten) bei verschwindendem Feld.
Die hier durchgeführten Untersuchungen beziehen sich auf den Dichtesprung und die kritische Isotherme. Im Ergebnis ist es damit möglich, durch Erweiterung des Geltungsbereichs kritischer Phänomene auf Temperaturen weit unterhalb der kritischen Temperatur wesentliche Schlußfolgerungen zum Zustandsverhalten realer Gase und Flüssigkeiten abzuleiten. Die Erweiterung des Geltungsbereichs kritischer Phänomene erfolgt als Hypothese, die durch die vorliegenden Ergebnisse durch Untersuchungen an konkreten Stoffdaten als berechtigt dargestellt ist.
Für reale Gase ergibt sich auf dieser Grundlage ein funktionaler Zusammenhang zwischen dem Druck p und dem molaren Volumen v auf einer Isotherme der Temperatur T entsprechend der Gleichung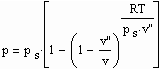 , (1)
, (1)
wobei ps der Dampfdruck, v’’ das molare Sättigungsdampfvolumen und R die allgemeine Gaskonstante ist.
Diese Gleichung beschreibt selbst Zustände in der Nähe der kritischen Temperatur als Näherung.
Es zeigt sich weiter, dass es mit den hier auf der Grundlage der Theorie kritischer Phänomene gewonnenen Ergebnissen möglich ist, eine allgemeine Beziehung abzuleiten, die die Berechnung des molaren Volumens v’’ trocken gesättigten Dampfes bei bekanntem Dampfdruck ps als Näherung ermöglicht:
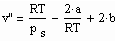 . (2)
. (2)
Dabei sind a und b die Parameter der klassischen van der Waals- Gleichung realer Gase mit a = 27R2 Tk 2 /64 pk und b = R Tk /8 pk, wobei pk der kritische Druck und Tk die kritische Temperatur ist. Genauere v“-Werte sind mit einem weiteren Näherungsschritt zu berechnen (s. „Stoffwerte von Flüssigkeiten und realen Gasen- berechnet mit Gesetzmäßigkeiten kritischer Phänomene“, ISBN 978-3-00-027253-0).
In Auswertung der zu kritischen Phänomenen durchgeführten Untersuchungen ergab sich weiterhin die folgende Gleichung:
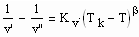 . (3)
. (3)
Dabei ist b ein sogen. kritischer Exponent, der universell mit b = 1/3 gültig ist. Kv ist die sogen. Dichtesprungkonstante, die leicht mit einem bei niedriger Temperatur bekanntem v’- Wert bestimmt werden kann (wenn also 1/v’’ verschwindend klein ist).
Die obige Gleichung (3), die dem Dichtesprung zwischen Flüssigkeit und Dampf entspricht, ermöglicht die Berechnung des Sättigungsvolumens v’ der Flüssigkeit bei gegebener Temperatur, wenn v’’ bereits mit (2) berechnet werden konnte.
Eine in den Zustandsvariablen p, v, T bestehende thermische Zustandsgleichung werde mit ZG(p,v,T) = 0 bezeichnet. Die Zustandsgleichung ZG kann die van der Waals- Gleichung , die Virialgleichung oder auch eine andere die Variablen p, v, T enthaltende sinnvolle Gleichung sein.
Wenn nun für eine bestimmte Temperatur der Dampfdruck ps gegeben ist, muß
ZG(ps ,v’,T) = 0 und ZG(ps , v’’, T) = 0 gelten. Außerdem muß das Maxwell- Kriterium
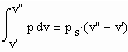 (4)
(4)
erfüllt sein. Zur Anwendung von (4) muss die Zustandsgleichung ZG in einer druckexplizieten Form p = p(v,T) vorliegen, um die erforderliche Integration über p(v,T) bei festem T ausführen zu können.
Damit bestehen die folgenden zwei Gleichungen :
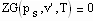 ,
,
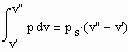 . (5)
. (5)
Da das Gleichungssystem (5) zwei Gleichungen enthält, können zwei Unbekannte bestimmt werden. Bei vorgegebener Temperatur, bekanntem Dampfdruck und den mit den Gleichungen (2) und (3) ebenfalls bekannten Volumina v‘, v‘‘ können das die in der Zustandsgleichung ZG(p,v,T) = 0 enthaltenen unbekannten Parameter der Zustandsgleichung sein. Am Beispiel der van der Waals- Gleichung kann das sehr einfach verdeutlicht werden.
Werden die Parameter a, b der klassischen van der Waals- Gleichung nicht als Konstanten, sondern als mit der Temperatur variabel betrachtet, können nun die Parameter a, b temperaturabhängig mit (5) bestimmt werden.
Es zeigt sich, dass man auf diese Art und Weise tatsächlich sinnvolle Ergebnisse erhält. Sowohl für Zustandsgleichungen des van der Waals- Typs als auch für andere Gleichungen können so die entsprechenden Parameter dieser Gleichungen temperaturabhängig mit (5) berechnet werden, so dass man damit dann mit der jeweiligen Zustandsgleichung die Volumina von Flüssigkeiten bei gegebenem Druck und vorgegebener Temperatur berechnen kann. Die Fehler sind für Flüssigkeiten selbst für hohe Drücke gering in der Größenordnung von nur einigen Prozent.
Die Volumina realer Gase können ohne Benutzung einer der bisher üblichen Zustandsgleichungen mit (1) berechnet werden. Allerdings nimmt die Genauigkeit bei zunehmender Annäherung an die kritischen Daten ab.
Auch die mit (2) berechenbaren Tauvolumina v“ werden mit zunehmender Nähe zu kritischen Daten ungenauer. Es besteht aber die Möglichkeit, bedeutend genauere Tauvolumina- Werte zu berechnen, wenn die mit (2) sich ergebenden v“- Werte als eine erste Näherung des o.gen. Gleichungssystems und als eine Grundlage für weitere Iterationen angesehen werden.
Zusammenfassend ist zu sagen, daß die Berechnung von erfreulich genauen v‘- und v“- Werten auf der Grundlage der angedeuteten erweiterten Theorie kritischer Phänomene so möglich wird, daß zur Berechnung dieser Daten nur der kritische Druck, die kritische Temperatur und ein Zustandspunkt bei niedrigem Dampfdruck ( mit der entsprechenden Temperatur und den zu dieser Temperatur gehörenden Volumina v‘ und v“) bekannt sein muß – es kann sich dabei um den normalen Siedepunkt handeln.
Auch die Realgasfaktoren Z=pv/RT von Stoffen für den Flüssigkeits- und Gaszustand lassen sich so recht einfach als Näherungen bestimmen.
Selbst die näherungsweise Bestimmung kritischer Daten eines Stoffes erweist sich auf der Grundlage der Erweiterung der Gültigkeit kritischer Phänomene als möglich.
Die Darstellung der Theorie, die Ableitung der Gleichungen verbunden mit Berechnungsbeispielen ist in „Stoffwerte von Flüssigkeiten und realen Gasen -berechnet mit Gesetzmäßigkeiten kritischer Phänomene“ (2009, ISBN 978-3-00-027253-0, nicht im Buchhandel erhältlich) enthalten.
This entry was posted
on Donnerstag, Mai 7th, 2009 at 3:47 pm and is filed under kritische Phänomene, Theorie der Flüssigkeiten und Gase, Zustandsgleichung.
You can follow any responses to this entry through the RSS 2.0 feed.
Both comments and pings are currently closed.
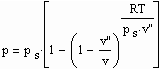 , (1)
, (1)![]() . (2)
. (2)![]() . (3)
. (3)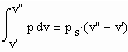 (4)
(4)![]() ,
,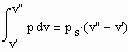 . (5)
. (5)