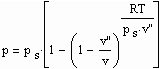Aus der physikalischen Theorie kritischer Phänomene kann für reale Gase die Zustandsfunktion
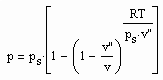 (1)
(1)
für Zustände entfernt vom kritischen Punkt bzw. für kleine bis mäßige Drücke abgeleitet werden (p- Druck/ MPa, ps- Dampfdruck/ MPa, T- Temperatur / K, v- molares Volumen / cm³/mol, v“- molares Sattdampfvolumen / cm³/mol ). Die Funktion (1) ist als grobe Näherung anwendbar. Sie ist anwendbar auch für hohe Temperaturen, sogar bis über die kritische Temperatur hinaus. Ihre Anwendbarkeit für Zustände nahe des kritischen Punktes ( einige Kelvin unterhalb und oberhalb der kritischen Temperatur Tk und für Drücke in der Nähe des kritischen Druckes pk ) ist nicht zu erwarten, da hier besondere und andere Bedingungen gelten, die sich aus Gesetzmäßigkeiten kritischer Phänomene im Unterschied zur bisherigen van der Waals- Thermodynamik ergeben.
Auf der kritischen Isotherme können entsprechend der Gesetzmäßigkeiten kritischer Phänomene nahe des kritischen Druckes die Relationen
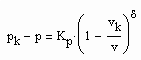 (2)
(2)
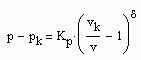 (3)
(3)
vorausgesetzt werden. Dabei ist Kp ein Proportionalitätsfaktor und δ der entsprechende kritische Exponent. (2) gilt für p ‹ pk , (3) gilt für p › pk.
Für p,v – Zustände nahe pk, vk ist (2), (3) zwingend mit einem in der Theorie kritischer Phänomene erklärten kritischen Exponenten zu rechnen. Der kritische Exponent δ ist resultierend aus Messungen in der Größenordnung von 4.0 bis 4.8 festgestellt worden (s. z. B. Nolting, W.: Statistische Physik, Springer Verlag 2004). Es gibt Physiker, die kritische Exponenten im Sinne absoluter Naturkonstanten unabhängig vom Stoff interpretieren und andere, die eine Stoffabhängigkeit in Grenzen zugestehen. Setzt man die weitgehende Stoffunabhängigkeit voraus, verbleibt der Proportionalitätsfaktor Kp als Unbekannte. Es besteht die Frage, wie ist der Proportionalitätsfaktor Kp zu bestimmen, um Zustände auf der kritischen Isotherme berechnen zu können?
Sinnvoll ist es, die Frage allgemeiner zu stellen. Nämlich: Wie können nahkritische Zustandsdaten mit ausreichender Genauigkeit nicht nur für Zustände auf der kritischen Isotherme, sondern auch für Temperaturen kurz unter- und oberhalb der kritischen Temperatur bestimmt werden? Bisherige physikalisch begründete als auch die sogen. halbempirischen Zustandsgleichungen u.a. reichen nicht aus. Auch die von der bisherigen Theoretischen Physik erklärten Ansätze, die die rechnerische Bestimmung des Proportionalitätsfaktors Kp ohne Meßwerte kaum erlauben, reichen nicht aus. Für technisch wichtige Stoffe ist deshalb die Physikalische Chemie und Verfahrenstechnik auf empirische stoffspezifische Lösungen bei einem hohen meßtechnischen Aufwand angewiesen (vielparametrige empirische Zustandsgleichungen pro Stoff bei Voraussetzung hochgenauer Stoffwerte) ( s. z. B. die Stoffdaten für Erdgaskomponenten, für Kohlenstoffdioxid CO2, für Wasser usw. mit weitgehend empirischen Zustandsgleichungen von Wagner und Span, Universität Bochum, s. E.W. Lemmon u. R. Span: Multiparameter Equations of State for Pur Fluids and Mixtures. Chapter 12, in A.R.H. Goodwin, J.V. Sengers und C.Peters(Ed.): Applied Thermodynamics of Fluids. International Union of Pure and Applied Chemistry, Royal Society of Chemistry, Thomas Graham House,Cambridge, UK 2010)).
Bisherige Feststellungen und Schätzungen kritischer Exponenten für dreidimensionale physikalische Systeme mit einem Ordnungsparameter in der entsprechenden Universalitätsklasse wurden z. B. in Auswerung des Issing – Modells mit dem kritischen Exponenten β = 0.326 + – 0.002 und δ = 4.80+- 0.02 vorausgesetzt (s. z. B. J.V. Senger: Thermodynic Behavior of Fluids near the critical Points, Ann. Rev. Phys.Chem. 1986,37).
Vorliegende Ergebnisse zu Gesetzmäßigkeiten kritischer Phänomene bestätigen zwar die Existenz des kritischen Exponenten β in der Größenordnung von 1/3, nicht aber die Gültigkeit eines allgemeinen Exponenten δ etwa bei 4.8. Das in der Theoretischen Physik gen. Werteintervall δ = 4.0 bis 4.8 trifft zu und ist nach den vorliegenden Untersuchungen durchaus noch zu klein.
Die nachfolgenden Feststellungen weisen darauf hin, daß es möglich ist, einen physikalisch begründeten und empiriefreien Ansatz zur Nachrechnung nahkritischer Daten ohne zusätzlichen Meßaufwand zu finden.
Bestimmt man für die kritische Isotherme vergleichsweise für verschiedene Stoffe den Exponenten RTk/pk vk in (1), ist festzustellen: Es gibt Stoffe, deren Exponent RTk/pk vk in (1) in dem für den kritischen Exponenten δ erklärten Bereich zwischen 4.0 bis 4.8 liegt. Für Wasser z. B. ergibt sich 4.36, für Ammoniak NH3 4.12. Für solche Stoffe ist die weitgehende Gültigkeit der Funktion (1) auch im nahkritischen Bereich zu erwarten. Die kritische Isotherme sollte in diesen Fällen entsprechend (1) mit
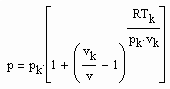 v‹ vk (4)
v‹ vk (4)
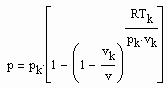 v›vk (5)
v›vk (5)
erfaßt werden können.
Ob das tatsächlich so ist, zeigt die Nachrechnung mit Daten gut vermessener Stoffe wie z. B. für Wasser.
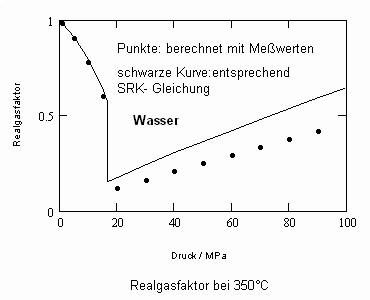
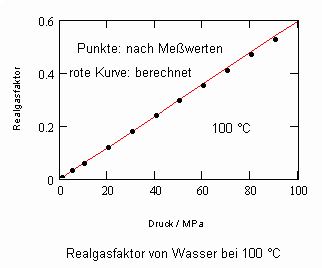
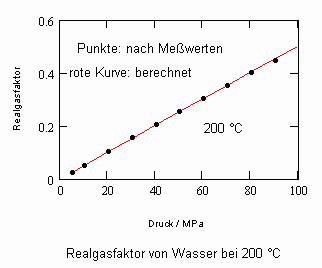
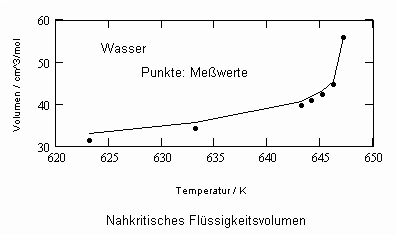
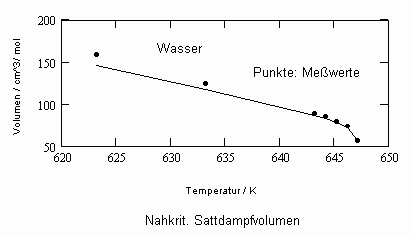
Wasser: (Tk= 647.15 K, pk= 22.055 MPa, vk= 55.9503 cm³/mol)
Bei einer Temperatur 648.15 K (375 °C, also 1°C über der kritischen Temperatur) und einem hypothetischen Dampfdruck von 22.286 MPa ergeben sich mit den o. gen. Funktionen (4), (5) im Vergleich mit aus Meßwerten berechneten Realgasfaktoren die folgenden Werte (außerdem sind die Werte angegeben, die sich mit einer der oft angewendeten Ingenieurgleichungen, der Soave- Redlich- Kwong- Gleichung berechnen lassen).
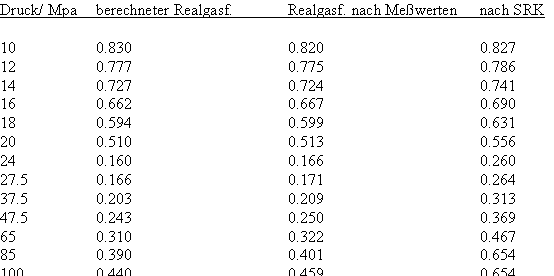
(Meßwerte L. Haar, J.S. Gallagher, G.S. Kell: NBS/NRC Wasserdampftafeln, Springer 1988)
Ein weiteres für die kritische Isotherme vermessenes und veröffentlichtes Beispiel ist
Schwefelhexafluorid SF6: (Tk= 318.7232 K, pk= 3.755 MPa, vk= 196.576 cm³/mol)
Bei einer Temperatur genau auf der kritischen Isotherme ergeben sich mit den o.gen. Funktionen (4), (5) im Vergleich mit aus Meßwerten berechneten Realgasfaktoren die folgenden Werte:

Die gen. Beispiele u.a. zeigen die Anwendbarkeit der Funktionen (4), (5) für kritische Verhältnisse.
Für Stoffe allerdings, deren Exponent RTk/ pk vk nicht in das von der physikalischen Theorie erklärte Wertebereich von ca. 4.0 bis 4.8 für kritische Exponenten fällt, bestehen andere Bedingungen. Allerdings ergibt sich auch für solche Stoffe die Möglichkeit, nahkritische Stoffdaten rechnerisch zu bestimmen. Es ist dazu nur die Kenntnis der kritischen Daten und die vorausgesetzte Temperatur ohne weitere Meßwerte erforderlich.
Die so feststellbare Zustandsfunktion p = p(T,v) gestattet dann auch die Berechnung kalorischer Größen- wie auch der wichtigen Freien Enthalpie für nahkritische Zustände.
Die vorliegenden Theorie – Ergebnisse sollen veröffentlicht werden.
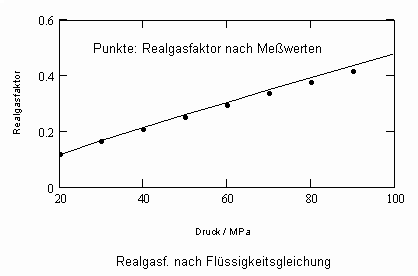
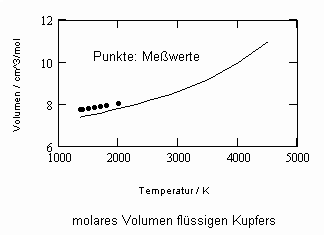
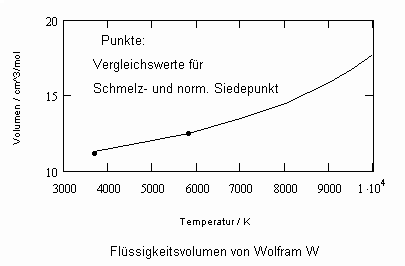
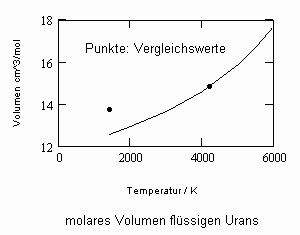
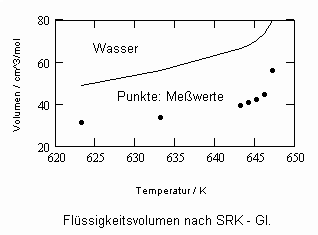
Die sich aus der Theorie kritischer Phänomene ergebenden Weiterentwicklungen ermöglichen es, allgemeine Aussagen zum pvT- Verhalten von Flüssigkeiten abzuleiten. Es ergibt sich eine Zustandsfunktion speziell für Flüssigkeitenvon niedrigen Temperaturen bis hin zu Temperaturen nahe der kritischen Temperatur. Damit kann bei vorgegebener Temperatur und vorgegebenem Druck das molare Volumen einer Flüssigkeit als Näherung selbst bis zu hohen Drücken von einigen 10 MPa und höher berechnet werden, wenn nur die kritischen und die Sättigungsdaten des jeweiligen Stoffes bekannt sind. Die Berechnung der Realgasfaktoren von Flüssigkeiten bis zu hohen Drücken ist somit bei guter Übereinstimmung mit Meßwerten möglich.
Für Flüssigkeitszustände bei Temperaturen niedriger bis mäßiger Dampfdrücke, d.h. weiter entfernt vom kritischen Punkt des jeweiligen Stoffes, ist mit den Mitteln der van der Waals- Thermodynamik die Zustandsfunktion
![]() (6)
(6)
ableitbar (b- Eigenvolumen der Moleküle des Stoffes/ cm³/mol, K-stoffspezifische Konstante mit der Dimension eines Druckes, die sich aus dem Dampfdruck ergibt) (s. Tampe,F.: Stoffwerte von Flüssigkeiten und Gasen- berechnet mit Gesetzmäßigkeiten kritischer Phänomene, 2009, ISBN 978-3-00-027253-0).Auch diese Funktion ermöglicht die Berechnung der Flüssigkeitsvolumina als Näherung für Drücke vom Dampfdruck bis weit darüber hinaus- z.B. für Wasser sogar bis 100 MPa. Mit dieser Funktion (6) und der aus der physikalischen Theorie kritischer Phänomene ableitbaren Zustandsfunktion für Flüssigkeiten nahe kritischer Werte ist die Berechnung von Flüssigkeitsdaten als Näherung in ihrem gesamten Existenzbereich von niedrigen bis zu hohen Temperaturen, vom Dampfdruck bis zu hohen Drücken möglich.
Die in der Technischen Thermodynamik , Physikalischen Chemie und Verfahrenstechnik bestehenden Ansätze, Stoffeigenschaften mit den Mitteln der bisherigen van der Waals- Thermodynamik, der Statistischen Thermodynamik mit Mitteln von Potential- Ansätzen der Quantenmechanik bzw. der sogen. molekularen Modellierung zu bestimmen, erweisen sich oft als kompliziert und empiriebelastet. Als viel einfacher gestalten sich die aus Gesetzmäßigkeiten kritischer Phänomene ableitbaren Berechnungsgleichungen, die nicht einmal Anpassungsrechnungen an vorausgesetzte empirische Parameter verlangen.
Weitere Beispiele zu Rechenergebnissen im Vergleich zu Meßwerten können die Anwendbarkeit der gewonnenen Theorie – Ergebnisse, die Näherungen der entsprechenden Stoffwerte erlauben, verdeutlichen: s. Anlage.
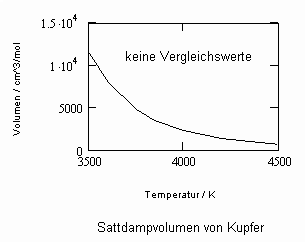
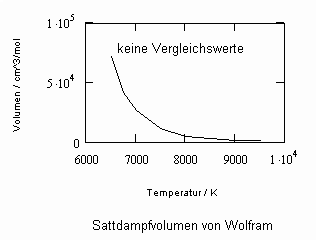
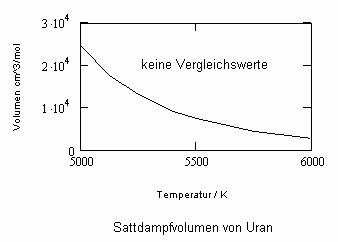
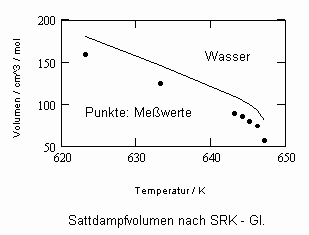
Oftmals sind Meßwerte des nahkritischen Sättigungszustandes von Stoffen unbekannt. Die Berechnung solcher Daten für Flüssigkeits- und Dampfvolumina bzw. für Dampfdrücke in der Nähe der kritischen Temperatur ist mit den gegenwärtig verfügbaren Berechnungsgleichungen (van der Waals- Gleichung, sogen. halbempirische Gleichungen nach Soave, Redlich, Kwong und Peng, Robinson u. a., Gleichungen der Statistischen Thermodynamik usw.) in vielen Fällen nicht möglich bzw. zu ungenau.
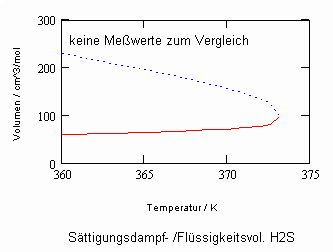
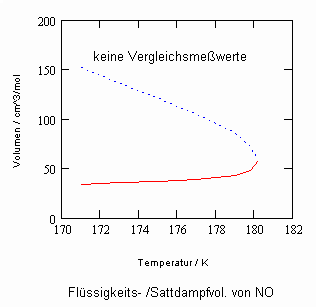
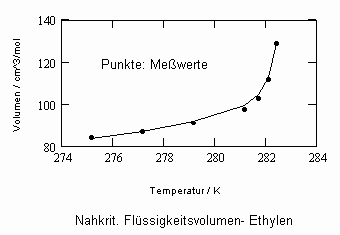
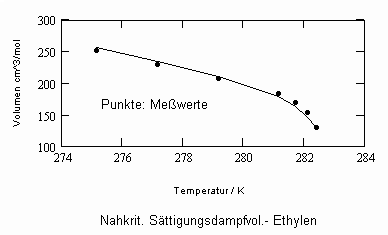
In Auswertung von Gesetzmäßigkeiten kritischer Phänomene ergibt sich nun die Möglichkeit, nahkritische Sättigungsvolumina bzw. die nahkritischen Dichten von Stoffen für Flüssigkeit und Dampf im Sättigungszustand in Abhängigkeit von der Temperatur zu berechnen. Die Berechnungsgleichungen dafür liegen vor. Die Ergebnisse sind Näherungen, die für den Flüssigkeitszustand sogar besser sind als für den Sattdampf (s. auch Artikel „Die Berechnung von Daten für Zustände kurz unter der kritischen Temperatur“ vom 22.2.2011 in www.dr-tampe.de )
Auf Folgendes ist hinzuweisen: Wenn die Zustandsfunktion p= p(v,T) eines Stoffes sowohl sowohl für den Flüssigkeits- als auch für den Gaszustand bekannt ist, muß es möglich sein, kalorische Daten dieses Stoffes zu berechnen. Zur Berechnung z.B. der für technische Belange wichtigen Enthalpie gilt
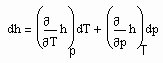 . (7)
. (7)
Da
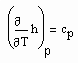 (8)
(8)
die spezifische Wärmekapazität ist, die gemessen werden kann, und für
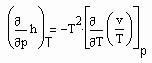 (9)
(9)
gilt, ist damit die Enthalpie eines Stoffes sowohl für den Flüssigkeitszustand als auch den Gaszustand berechenbar. Dies bedeutet weiter, daß so die Enthalpie eines Stoffes entlang der Dampfdruckkurve sowohl für die Flüssigkeit als auch für den Sattdampf als Näherung berechnet werden kann.
Anlage: Berechnungsbeispiele




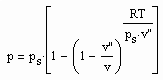 ,
,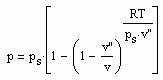
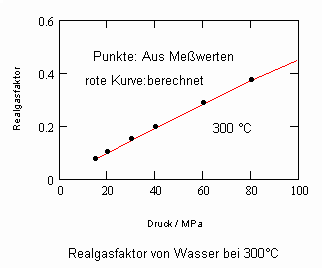
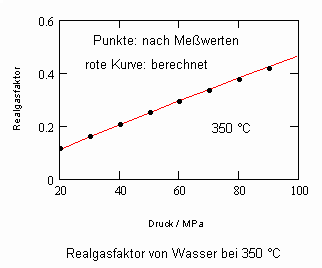
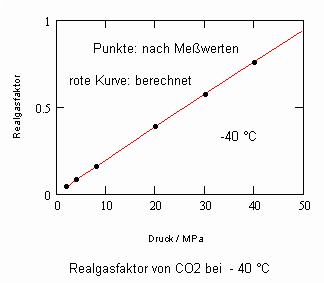
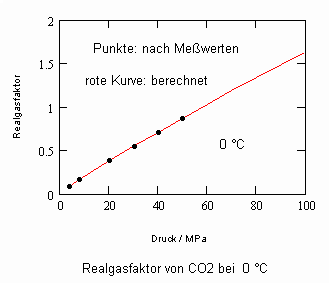


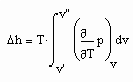
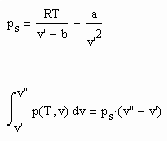
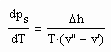 ,
,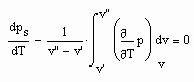
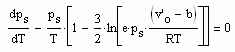 .
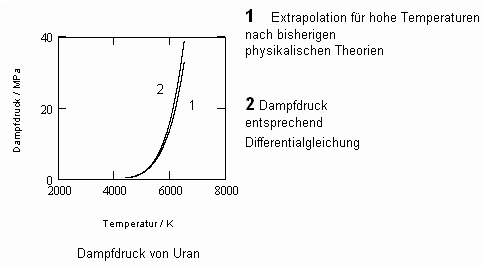
.
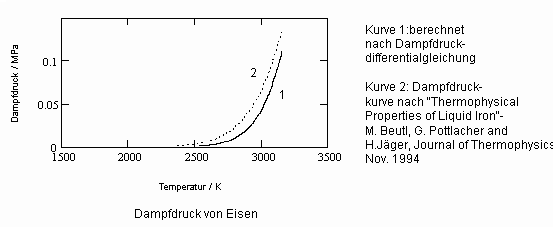
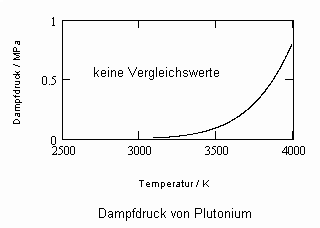
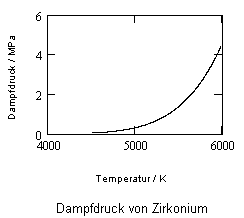
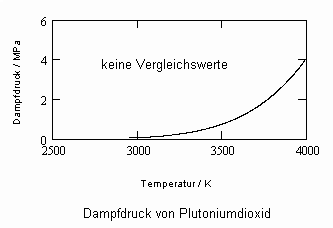
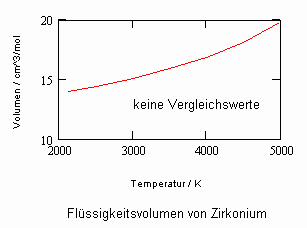
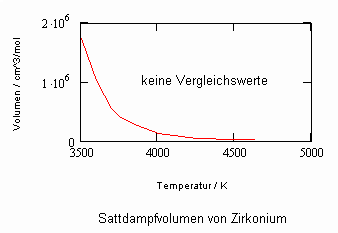
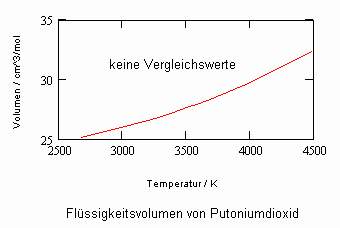
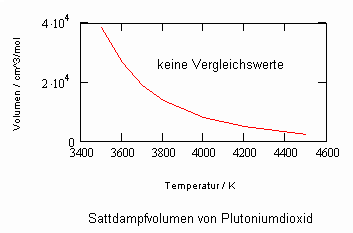
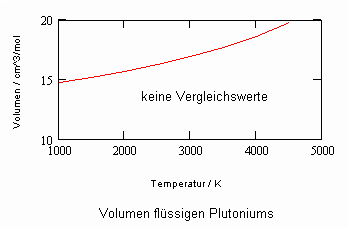
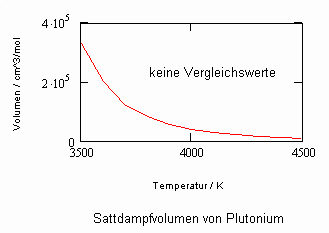
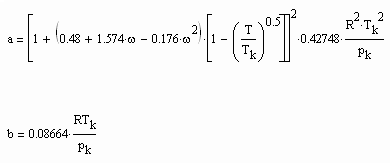
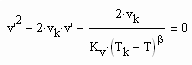 ,
,
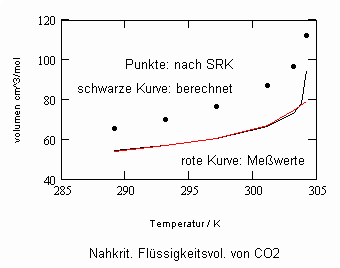
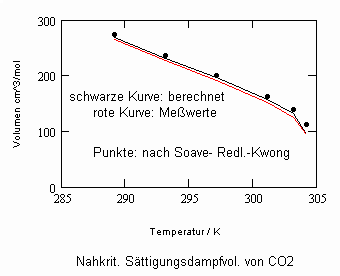
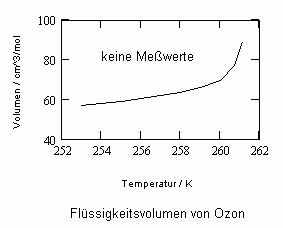 ,
,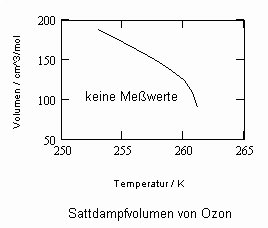 .
.